El ácido maleico tiene las siguientes características:


Tiene como punto de fusión 130°C. Sólido blanco cristalino con presentación en forma de pastillas, o en forma fundida, líquido transparente libre de insolubles, sedimentos y turbidez. Las principales aplicaciones del Acido Maleico son: Resina poliéster insaturada, la cual tiene múltiples aplicaciones, como pueden ser en la elaboración de botes, muebles de baño (refuerzos de spas y tina de hidromasaje, lavamanos, tarjas y WC), bases de cocina, sillas, concreto polimérico, losetas, autopartes, tuberías, tanques de almacenamiento. Fabricación de resina alquidal, que es la base de las pinturas alquidálicas que se aplican en pinturas automotrices y arquitectonicas. Elaboración de fertilizantes y agroquímicos, tales como el ácido fumárico.


Tiene como punto de fusión 270°C. Se forma en la piel durante la exposición a la luz solar, y también está disponible como suplemento oral y como preparación para uso tópico. Las formas esterificadas del ácido fumárico, como el monoetilester o el dimetilester del ácido fumárico, son las únicas que tienen un uso terapéutico.
Busca en tu material de estudio:
¿A qué se deben las propiedades físicas diferentes que ellos presentan?
Aquí te proporcionamos los modelos de sus moléculas. Obsérvalas.
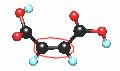
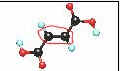
La Estereoquímica es el área de la química que estudia la estructura tridimensional de las moléculas y las consecuencias de ésta sobre sus propiedades físicoquímicas. En 1815, el físico francés Jean Baptiste Biot dio los primeros pasos en el campo de la estereoquímica al descubrir la actividad óptica, una propiedad de determinadas sustancias orgánicas que modifican el plano de rotación de la luz polarizada. En 1848, Pasteur utilizó este principio para separar tartratos mediante luz polarizada. El químico francés Joseph A. Le Bel y el químico físico holandés Jacobus H. van't Hoff explicaron en 1874, de forma independiente, ese fenómeno a partir de la estructura tetraédrica del carbono. Efectivamente, el centro de asimetría del átomo de carbono imprime una rotación inversa a la luz polarizada en cada uno de los "inversos ópticos" o "enantiómeros". Tres años más tarde, Emil Fischer explicó la estereoquímica de los azúcares, y en la década de 1910 el químico suizo Alfred Werner aplicó la estereoquímica a los compuestos de coordinación. La estructura de las moléculas no es rígida: los átomos o grupos que las componen pueden ser sometidos a movimientos de rotación y cambiar así de conformación. El estudio de esos cambios se denomina análisis conformacional, un área de la estereoquímica hoy en pleno auge. Es muy importante, sobre todo en las moléculas que presentan un interés desde el punto de vista biológico, conocer con precisión la forma que adopta en el espacio su estructura molecular. Por ejemplo, algunas enzimas presentan una disposición molecular que se puede deformar según el medio, con lo que favorecen o inhiben determinadas reacciones químicas; la estereoquímica permite comprender mejor cómo la hemoglobina transporta el oxígeno en la sangre, o ayudar a determinar la acción de un medicamento sobre una proteína. Cuando dos isómeros presentan una estructura tal que uno es la imagen especular del otro, se dice que son enantiómeros. Se dice que una molécula es quiral cuando no es superponible con su imagen especular; este concepto fue introducido por Pasteur. Una molécula es quiral cuando no posee ni plano de simetría ni centro de simetría. Una molécula quiral es ópticamente activa, y hace girar el plano de polarización de la luz polarizada a la derecha o a la izquierda. Existen diferentes métodos que permiten sintetizar moléculas quirales, y, por tanto, de controlar la quiralidad. Esto se emplea en particular en la síntesis de los medicamentos, que en su mayor parte están formados por moléculas quirales.
Para avanzar en tus conocimientos: es indispensable que adquieras los conceptos de ENANTIÓMEROS, CENTRO QUIRAL, DIASTEROISÓMEROS, MEZCLA RACÉMICA Y FORMA MESO.
Te presentamos el modelo de la molécula del ácido tartárico que tiene diasteroisómeros, (Ver material en Listromberg pág. 152)